Traitement parodontal non chirurgical
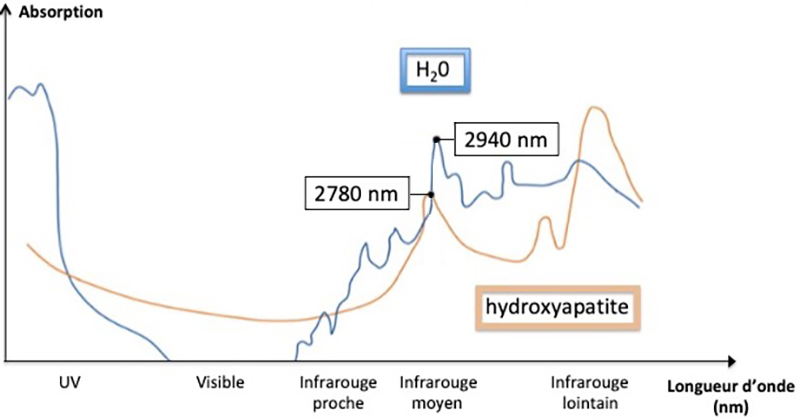
Le laser ablatif Er:YAG a été décrit pour ses effets bactéricides et de détoxification des surfaces. En effet, son efficacité a été démontrée sur le retrait des dépôts bactériens et des dépôts minéralisés sous-gingivaux, tout en induisant un stress mécanique et en préservant l’intégrité de la surface radiculaire(1). Le principe d’action est l’absorption de l’énergie par l’eau et les composés organiques des tissus afin d’induire une élévation de la température conduisant à une évaporation d’eau et in fine à l’expansion du tartre jusqu’à son détachement de la surface dentaire.
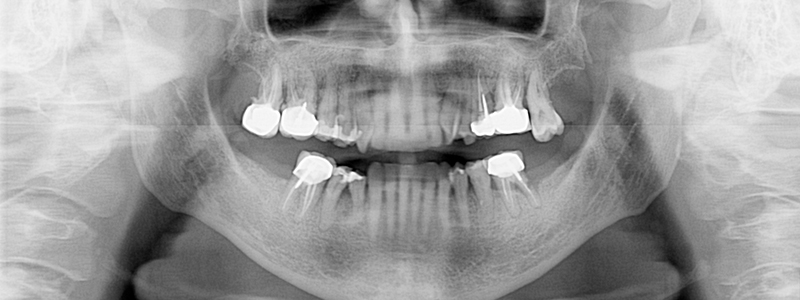
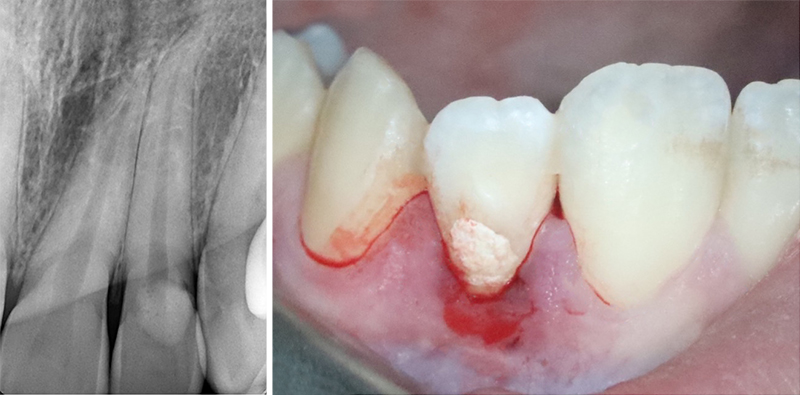
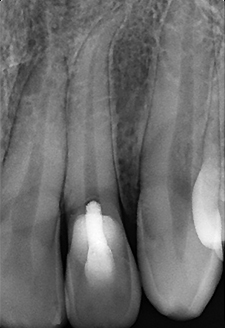
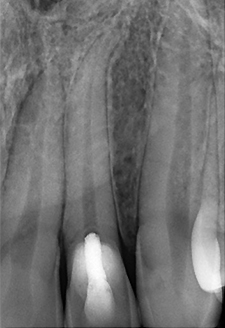
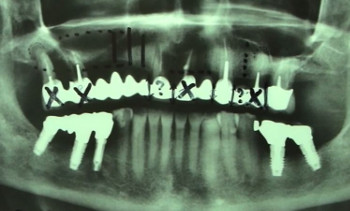
 Fig. 01 : dans ce cas clinique, la patiente souffrait d’une parodontite avancée. Lors de l’assainissement, des sécrétions purulentes étaient présentes. Nous avons donc utilisé le laser Er:YAG, dont l’action antibactérienne a permis de compléter l’assainissement par ultrasons. La cicatrisation a été très rapide, et aucun liquide séreux n’était présent lors du contrôle à 3 mois.
Fig. 01 : dans ce cas clinique, la patiente souffrait d’une parodontite avancée. Lors de l’assainissement, des sécrétions purulentes étaient présentes. Nous avons donc utilisé le laser Er:YAG, dont l’action antibactérienne a permis de compléter l’assainissement par ultrasons. La cicatrisation a été très rapide, et aucun liquide séreux n’était présent lors du contrôle à 3 mois.
Comme dans toute technique médicale, la balance coût-bénéfice doit être scrupuleusement évaluée par le praticien. La littérature ne montre pas d’effet bénéfique du laser Er:YAG par rapport au traitement non chirurgical classique mécanique ou ultrasonique en termes de retrait du tissu inflammatoire et clinique(2).
La méta-analyse de Salvi et al. de 2020 montre aussi que le laser Er:YAG utilisé en adjonction du traitement mécanique classique n’offre pas non plus de bénéfice clinique comparé au traitement mécanique seul : léger bénéfice en termes de réduction de profondeur de poche et gain d’attache, mais non significatifs.
D’autres types de laser ont aussi été évalués lors du traitement parodontal non chirurgical (laser Nd:YAG, laser dioxyde). Ces derniers ne sont pas efficaces pour le retrait de tartre sous-gingival, ils ont donc été étudiés pour leurs effets antimicrobiens en adjonction à l’instrumentation classique, mais les résultats sont controversés.
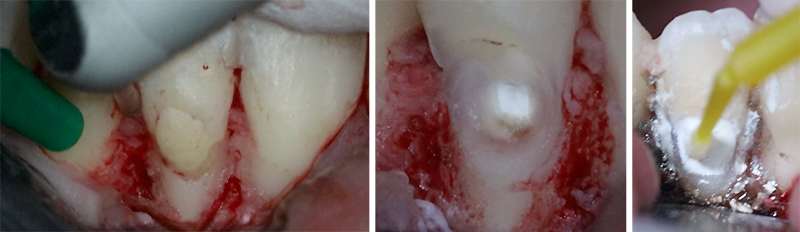
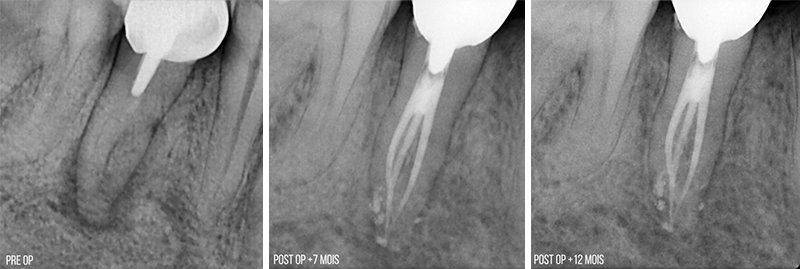
 Fig. 02 : dans les poches parodontales, nous allons préféré utiliser un tips avec un champs d’action initialement focalisé, puis qui se diffuse. Le Tips P600T de Morita,est particulièrement adapté pour les poches parodontales de taille moyenne. Un paramètre de 20 Hz – 50 mJ, sous spray d’eau stérile est recommandé avec ce tips, et un temps d’action assez court pour n’avoir qu’une action d’assainissement et non chirurgicale.
Fig. 02 : dans les poches parodontales, nous allons préféré utiliser un tips avec un champs d’action initialement focalisé, puis qui se diffuse. Le Tips P600T de Morita,est particulièrement adapté pour les poches parodontales de taille moyenne. Un paramètre de 20 Hz – 50 mJ, sous spray d’eau stérile est recommandé avec ce tips, et un temps d’action assez court pour n’avoir qu’une action d’assainissement et non chirurgicale.
La littérature actuelle ne montrant pas de bénéfice clinique évident lors de l’utilisation du laser, son utilisation et le coût additionnel associé à cette technique n’est alors pas justifié. C’est pour cette raison que dans les recommandations de l’European Federation of Periodontology (EFP) de 2020, il est suggéré de ne pas utiliser le laser en adjonction à l’instrumentation sous gingivale classique(3).
De la même manière, l’utilisation du laser lors du traitement parodontal chirurgical résectif ou régénératif n’est pas recommandé non plus en raison de son bénéfice clinique négligeable et du manque de preuves scientifiques(4).
Traitement des maladies péri-implantaires
Dans le traitement non chirurgical des mucosites et péri-implantites, la décontamination de la surface implantaire exposée est l’étape clé à la résolution de l’inflammation et à la guérison des lésions. L’utilisation du laser a alors été testée en monothérapie et en adjonction au traitement mécanique seul, mais ne montre aucun bénéfice clinique supplémentaire.
Une étude conduite sur 220 patients(5) montre une guérison des mucosites de 31% avec le traitement mécanique seul et de 34% avec le laser utilisé en adjonction.
De la même façon, le laser Er:YAG ne montre pas de bénéfice histologique et clinique dans le traitement des péri-implantites(6, 7, 8) comparé au traitement mécanique seul.
Environ 50% des péri-implantites traitées de manière non chirurgicale nécessitent secondairement une prise en charge chirurgicale, quelle que soit la technique non chirurgicale utilisée, le laser ne faisant pas exception.
Lors du traitement chirurgical des péri-implantites, le laser permet de décontaminer efficacement la surface implantaire tout en préservant son intégrité. Le laser Er:YAG n’interagit pas avec le métal et le laisse intègre. Cependant, le laser ne montre pas de bénéfice clinique comparé aux autres méthodes de décontamination(9).
Chirurgie muco-gingivale ablative
En chirurgie muco-gingivale, différents lasers ont été testés pour diverses applications cliniques, comme le prélèvement ou la désépithélialisation de greffon autologue palatin, mais son innocuité et leur supériorité clinique par rapport aux autres techniques n’ont jamais été démontrées.
Néanmoins, l’utilisation du laser Er:YAG lors des chirurgies muco-gingivales résectives (frénectomie, élongation coronaire, gingivectomie) a été largement évaluée dans la littérature. En comparaison à l’utilisation de la lame froide ou du bistouri électrique, le laser permet de réduire le saignement per-opératoire et les douleurs post-opératoires, tout en offrant une efficacité clinique similaire(10).
La stimulation de la coagulation permet également un gain de temps opératoire et de cicatrisation pour le patient.
Chirurgie des tissus durs
La micro-ablation osseuse sans effet thermique, caractérisée par une faible diffusion et une irrigation efficace, offre une approche novatrice. Cette technique se distingue par l’absence de débris de fraisage, permettant ainsi une élimination des substances toxiques et des matières organiques à la surface de l’os irradié, assurant ainsi une intervention sur un os propre.
Un avantage notable réside dans la stimulation de la cicatrisation, comme démontré par l’étude de Kesler et ses collaborateurs en 2011(11). Cette méthode favorise la sécrétion de facteurs de croissance dérivés des plaquettes, induisant ainsi une cicatrisation stimulée. L’explication de ce phénomène repose sur la création de micro-irrégularités qui facilitent l’attraction du caillot sanguin, favorisant ainsi la concentration des facteurs de cicatrisation. Cette approche se présente comme un puissant biostimulant.
Les applications de cette technique sont diverses, notamment dans la sculpture tissulaire. Elle peut être employée pour des procédures telles que l’allongement coronaire ou la régulation de la crête. De plus, elle trouve une utilité précieuse dans la sculpture des greffons cortico-spongieux, démontrant ainsi sa polyvalence dans la chirurgie des tissus durs.
Conclusion
Le laser Er:YAG séduit souvent le praticien pour les chirurgies. Il a la capacité de réaliser un curetage sélectif des tissus mous. De plus, il permet une cautérisation en superficie, permettant une meilleure visibilité pour l’opérateur et un gain de temps opératoire. Pour les tissus osseux, en plus de ne pas apporter de débit de fraisage, l’irradiation stimule la cicatrisation.
Mais l’utilisation du laser ne se traduit pas toujours par un avantage significatif par rapport à d’autres techniques, et ses bénéfices sont souvent tempérés par le coût élevé de l’appareil. Également, en raison de sa taille imposante, l’appareil nécessite d’être positionné à proximité du fauteuil plutôt que d’être directement intégré à celui-ci. Cette contrainte logistique peut constituer un inconvénient pratique.
Pour conclure, le laser est un outil très polyvalent, efficace et ergonomique, qui trouvera sa place dans les cabinets d’omnipratique ou d’endodontie exclusive.
Pour d’autres spécialités, le bénéfice du laser par rapport à d’autres techniques est encore à évaluer et à mettre en relation avec le coût important de l’appareillage.
En parodontologie notamment, bien que le laser Er:YAG ait prouvé son efficacité dans le traitement initial non chirurgical, le bénéfice clinique attendu reste équivalent aux autres techniques conventionnelles qui sont moins onéreuses. L’intérêt pour le patient doit toujours rester au centre de nos choix thérapeutiques, le laser n’échappant pas à cette règle.
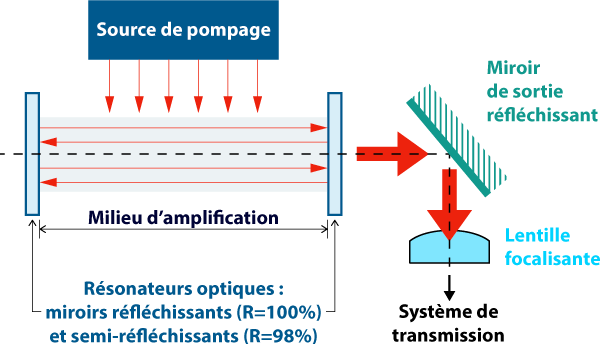
Cet article est le troisième de la série sur le laser Er:YAG des Drs Cléa Wagner, Romain Gabriel et Alexia Larderet. Retrouvez les deux premières publications en intégralité sur Dentalespace : L’introduction sur l’utilisation du laser en odontologie et Les principes et applications du laser Erbium YAG en odontologie.
Références bibliographiques
(1) Ishakawa et al. – Long-term histologic analysis of bone tissue alteration and healing following Er:YAG laser irradiation compared to electrosurgery.
Journal of Periodontology, 2009.
(2) Schwarz et al. – Laser application in non-surgical periodontal therapy: a systematic review.
J Clin Periodontol. 2008;35(8 Suppl):29-44.
(3) Sanz et al. – Traitement de la parodontite de stade I-III –Les recommandations S3 de l’EFP en pratique clinique.
J Clin Periodontol. 2020;47:4–60.
(4) Behdin et al. – Effectiveness of Laser Application for Periodontal Surgical Therapy: Systematic Review and Meta-Analysis.
Clinical Science, 2015.
(5) Aimetti et al. – Adjunctive efficacy of diode laser in the treatment of peri-implant mucositis with mechanical therapy: A randomized clinical trial.
Clinical oral implants research, 2019.
(6) Schwarz et al. – Clinical evaluation of an Er:YAG laser for nonsurgical treatment of peri-implantitis: a pilot study.
Clinical oral implants research, 2004.
(7) Schwarz et al. – Influence of fluorescence-controlled Er:YAG laser radiation, the Vector™ system and hand instruments on periodontally diseased root surfaces in vivo.
J Clin Periodontol. 2006.
(8) Schwarz et al. – Laser wavelengths and oral implantology.
Lasers Med Sci, 2009.
(9) Ting et al. – Laser decontamination microscopic process study on radioactive contaminations with Cs+ ion of 304 stainless steel surface.
Applied radiation and isotopes, volume 182, 2022.
(10) Silva et al.
2022.
(11) Kesler et al. – Platelet Derived Growth Factor Secretion and Bone Healing After Er:YAG Laser Bone Irradiation.
Journal of Oral Implantology 37 Spec No(sp1):195-204, 2011.