Hygiène interdentaire et hygiène orale
La prévention et le traitement de l’ensemble des maladies orales reposent sur une hygiène orale efficace et régulière. Le brossage dentaire électrique ou manuel est nécessaire mais ne permet pas d’éliminer totalement la plaque dentaire et de diminuer la charge bactérienne de manière suffisante. Les études montrent qu’après 1 min de brossage, seuls 39% de la plaque dentaire est éliminée (1). Aujourd’hui, les recommandations sont donc un brossage bi-quotidien de 2 min (https://www.ufsbd.fr). Cependant, les surfaces dentaires ne sont pas les seules à retenir la plaque. Les surfaces muqueuses notamment le dos de la langue et les amygdales sont des réservoirs bactériens importants (2) de même que les espaces interdentaires (Figure 1). Le contrôle de plaque supragingival est efficace sur la composition et la maturation de la plaque sous-gingivale qui est le facteur étiologique des maladies parodontales (3).
Plus largement, la prévention des gingivites et des parodontites par des techniques et des moyens d’hygiène orale adaptés à chaque patient est un enjeu majeur de santé générale. De nombreuses études ont montré que les maladies parodontales peuvent initier ou aggraver d’autres maladies chroniques (4).
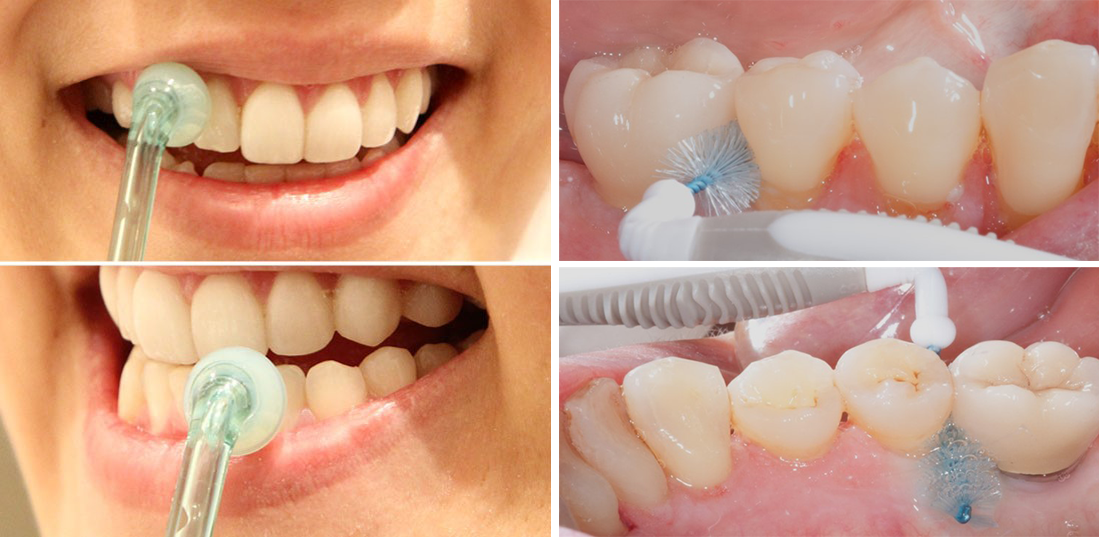
Figure 1 : Le contrôle de plaque interdentaire fait partie du traitement des parodontites (photos de droite) et participe à leur prévention primaire (chez les patients au parodonte sain, photos de gauche) et secondaire (chez les patients atteints de gingivite)
Les maladies parodontales
Conséquences locales
Les maladies parodontales sont des maladies d’origine bactérienne, inflammatoires et multifactorielles. Au niveau local, l’inflammation induite par le microbiote oral (ensemble des micro-organismes des différentes niches écologiques de la cavité orale) est responsable de la destruction des tissus parodontaux (5). L’inflammation gingivale est caractérise par l’œdème et le saignement gingival spontané ou provoqué par le sondage parodontal (gingivite). L’accumulation de la plaque supra et sous-gingivale favorisée par l’inflammation s’accompagne fréquemment d’une halitose qui peut être le motif de consultation de nombreux patients. En effet les maladies parodontales sont généralement non douloureuses. Les symptômes qui inquiètent les patients comme les récessions, la mobilité dentaire et la perte dentaire sont tardifs, ce qui explique que les maladies parodontales soient encore sous-diagnostiquées et sous-traitées alors que près d’un adulte sur deux est atteint de parodontite chronique (6, 7). Les maladies parodontales impactent fortement la qualité de vie (8) mais aussi la santé générale (9).
Conséquences générales
Depuis les années 1990, de nombreuses pathologies générales ont été associées aux maladies parodontales dans des études épidémiologiques bien conduites. Les mécanismes biologiques expliquant ces relations ont été établis par des études chez l’animal et des études cliniques. Certaines études d’intervention ont également permis d’établir que le traitement parodontal (non chirurgical et chirurgical) a des bénéfices sur les paramètres biologiques systémiques. Un récent Workshop européen a fait le point sur ces relations entre les maladies parodontales et les maladies cardiovasculaires liées à l’athérosclérose, les diabètes et les complications de la grossesse (4, 10, 11).
• Les maladies cardiovasculaires
Les maladies parodontales sont associées aux maladies cardiovasculaires liées à l’athérosclérose (maladies coronariennes, maladies neurovascuaires, artériopathie des membres inférieurs) surtout chez les moins de 65 ans (12). Le risque d’infarctus du myocarde est ainsi augmenté de 24 % et celui d’accident vasculaire cérébral de 74 % en cas de parodontite chronique (13, 14). Il a été aussi montré que l’hypertension augmente lorsque le nombre de dents en bouche est inférieur à 10 et qu’il existe une inflammation gingivale avec présence de plaque et de tartre (15).
• Les diabètes
Les parodontites sont décrites comme la 6ème complication la plus fréquente du diabète de type 2 (16). Si il est bien connu que les diabétiques ont plus de risque de développer une maladie parodontale et de souffrir de formes plus sévères que les non diabétiques, le risque que représente la maladie parodontale au niveau métabolique est tout aussi important (17). Puisque, les études les plus sérieuses indiquent que les parodontites ont des effets négatifs sur l’équilibre de la glycémie et augmentent les complications des diabètes (10). Les atteintes micro et macro vasculaires chez les diabétiques ont des conséquences graves : cécité, insuffisance rénale terminale (dialyse) et accidents vasculaires cérébraux notamment.
• Sur les complications de la grossesse
Les parodontites chez la mère augmentent le risque de pré-éclampsie qui est une forme d’hypertension caractéristique de la grossesse et peut-être le risque de prématurité (11). Même si les liens de causalité sont insuffisants, l’existence d’une association entre parodontites et complications graves de la grossesse justifient que les femmes en âge d’être mères atteintes de maladie parodontale soient alertées des risques qu’elles-mêmes et leurs enfants à naître encourent.
Les mécanismes biologiques qui expliquent ces liens entre la santé parodontale et la santé générale (Figure 2) sont médiés par l’inflammation systémiques et la bactériémie parodontale (18). Les patients atteints de parodontite chronique présentent une élévation systémique des médiateurs inflammatoires, cytokines pro-inflammatoires (IL-1 et IL- 6), du TNFα et des protéines de la phase aiguë de l’inflammation. Ainsi, il a été montré que le taux de CRP plasmatique augmente de 1,7 mg/L en cas de parodontite (19).
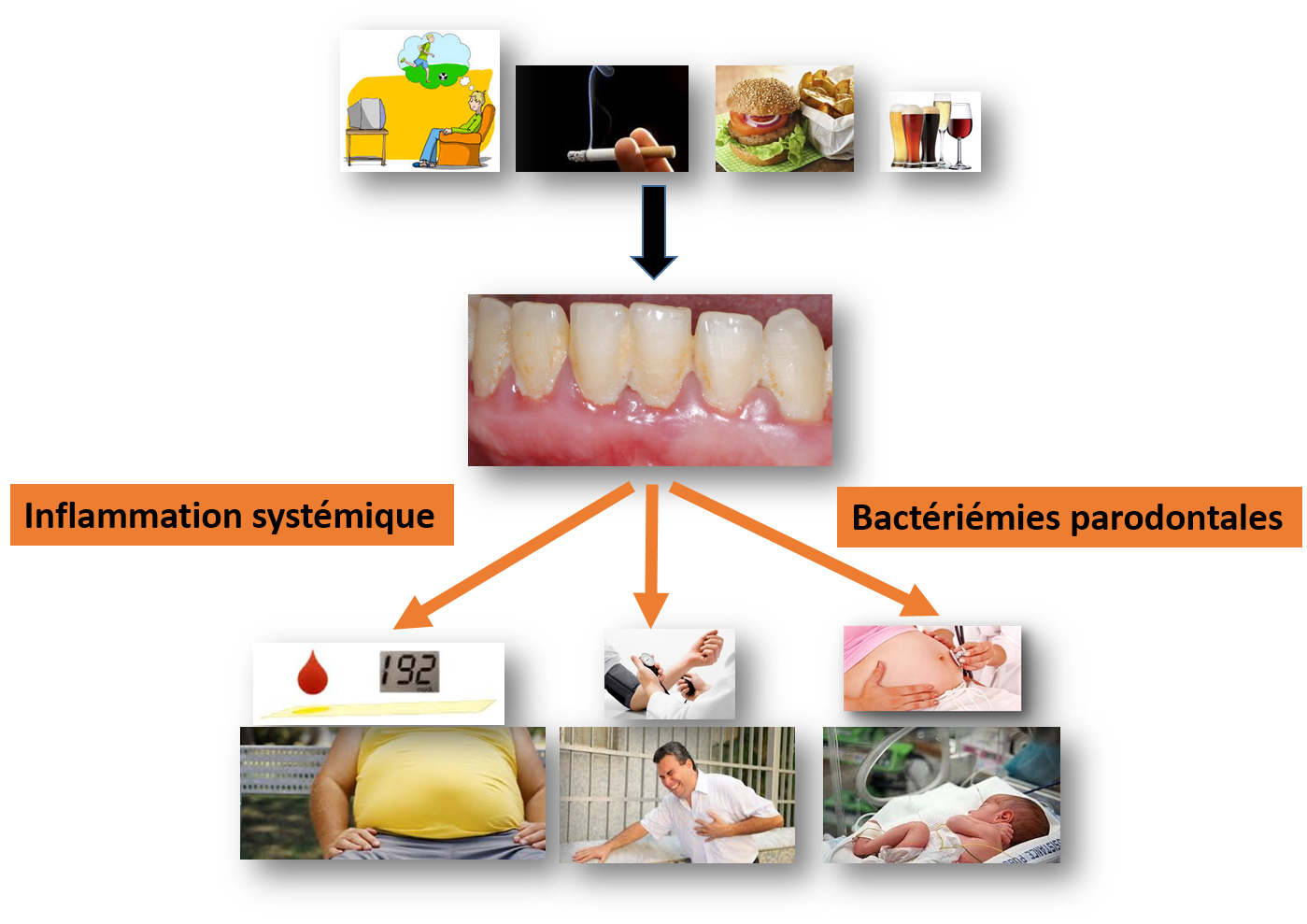
Figure 2 : Les maladies parodontales et les autres maladies inflammatoires sont liées par des mécanismes biologiques : les bactériémies parodontales et l’inflammation systémique.
Les bactéries peuvent également jouer un rôle direct dans les relations entre maladies parodontales et maladies systémiques. Les bactéries parodontales sont notamment capables de se fixer et de pénétrer dans les cellules vasculaires, d’échapper aux cellules de défense (leucocytes) et d’initier des lésions d’athérosclérose (20). Ainsi de l’ADN de bactéries parodontales est retrouvé dans des plaques d’athérome au niveau des artères carotides (21).
Traitement des parodontites et hygiène de vie parodontale
Aujourd’hui il faut rappeler que les traitements parodontaux sont sûrs et très efficaces puisque chez les patients traités et bénéficiant d’une maintenance parodontale régulière, le taux de perte dentaire est extrêmement bas (22). Au niveau général, les bénéfices du traitement parodontal a été clairement montré par de nombreuses études sur l’amélioration du bilan biologique des patients notamment par diminution du taux de CRP de -0,71 mg/L et du taux d’HbA1C de -0,36 % (23, 24).
Toutefois, le meilleur traitement parodontal professionnel est voué à l’échec sur le long terme en absence d’un contrôle de plaque personnel efficace et régulier (25). Or la qualité du contrôle de plaque est le plus souvent insuffisante et les études montrent que l’amélioration du contrôle de plaque est indissociable d’un enseignement personnalisé des techniques d’hygiène orale accompagné d’une prescription de matériel adapté à chaque situation (26).
Les dernières études à haut niveaux de preuve montrent une réduction des indices de plaque et d’inflammation (gingivite) avec le brossage dentaire électrique qu’il utilise une technologie oscillo-rotative ou sonique (27). Ces différentes brosses à dents électriques présentent des avantages et des inconvénients qu’il appartient au praticien d’apprécier en fonction de chaque patient. Rappelons que les brosses soniques ont des têtes semblables à des têtes de brosses manuelles et n’exigent pas de méthode de brossage particulière favorisant ainsi la compliance du patient vis-à-vis du brossage électrique. La brosse doit seulement être placée au niveau du collet, si possible avec une orientation à 45° en direction du sulcus, puis guidée de manière à parcourir l’ensemble de la denture pendant la durée du programme choisi, généralement 2 minutes.
Enfin, l’hygiène des espaces interdentaires est efficacement assuré par les brossettes interdentaires en cas de parodontite et par le fil dentaire en prévention primaire (parodonte sain) et secondaire (gingivite) (28). Il existe des alternatives intéressantes en termes de matériel destiné à l’hygiène interdentaire pour améliorer le confort des patients tel que l’AirFloss (Philips Sonicare). Bien que très simple d’utilisation, l’AirFloss possède une action anti plaque qui se manifeste cliniquement par une réduction des indices de plaque, d’inflammation et de saignement similaire à celle obtenue avec le fil dentaire (29). Par ailleurs, il est possible d’ajouter un bain de bouche antimicrobien délivré dans chaque espace interdentaire par l’Air Floss, ce qui augmenterait l’efficacité du contrôle de plaque interproximal (27).
Preuve s’il en était besoin que l’hygiène interdentaire est efficace, utile et donc indispensable au maintien de la santé parodontale qui est indissociable de l’état de santé général.
Cet article vous est proposé par Philips.
Références
1. Van der Weijden GA, Timmerman MF, Nijboer A, Lie MA, Van der Velden U. A comparative study of electric toothbrushes for the effectiveness of plaque removal in relation to toothbrushing duration. Timerstudy. J Clin Periodontol. 1993;20(7):476-81.
2. Quirynen M, Bollen CM, Vandekerckhove BN, Dekeyser C, Papaioannou W, Eyssen H. Full- vs. partial-mouth disinfection in the treatment of periodontal infections: short-term clinical and microbiological observations. J Dent Res. 1995;74(8):1459-67.
3. Loe H, Theilade E, Jensen SB. Experimental Gingivitis in Man. J Periodontol. 1965;36:177-87.
4. Tonetti MS, Van Dyke TE, working group 1 of the joint EFPAAPw. Periodontitis and atherosclerotic cardiovascular disease: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Periodontol. 2013;84(4 Suppl):S24-9.
5. Darveau RP. Periodontitis: a polymicrobial disruption of host homeostasis. Nat Rev Microbiol. 2010;8(7):481-90.
6. Eke PI, Dye BA, Wei L, Slade GD, Thornton-Evans GO, Borgnakke WS, et al. Update on Prevalence of Periodontitis in Adults in the United States: NHANES 2009 to 2012. J Periodontol. 2015;86(5):611-22.
7. Bouchard P, Boutouyrie P, Mattout C, Bourgeois D. Risk assessment for severe clinical attachment loss in an adult population. J Periodontol. 2006;77(3):479-89.
8. Buset SL, Walter C, Friedmann A, Weiger R, Borgnakke WS, Zitzmann NU. Are periodontal diseases really silent? A systematic review of their effect on quality of life. J Clin Periodontol. 2016;43(4):333-44.
9. Cullinan MP, Seymour GJ. Periodontal disease and systemic illness: will the evidence ever be enough? Periodontol 2000. 2013;62(1):271-86.
10. Chapple IL, Genco R, Working group 2 of joint EFPAAPw. Diabetes and periodontal diseases: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Clin Periodontol. 2013;40 Suppl 14:S106-12.
11. Sanz M, Kornman K, Working group 3 of joint EFPAAPw. Periodontitis and adverse pregnancy outcomes: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Clin Periodontol. 2013;40 Suppl 14:S164-9.
12. Dietrich T, Sharma P, Walter C, Weston P, Beck J. The epidemiological evidence behind the association between periodontitis and incident atherosclerotic cardiovascular disease. J Clin Periodontol. 2013;40 Suppl 14:S70-84.
13. Lafon A, Pereira B, Dufour T, Rigouby V, Giroud M, Bejot Y, et al. Periodontal disease and stroke: a meta-analysis of cohort studies. Eur J Neurol. 2014;21(9):1155-61, e66-7.
14. Humphrey LL, Fu R, Buckley DI, Freeman M, Helfand M. Periodontal disease and coronary heart disease incidence: a systematic review and meta-analysis. J Gen Intern Med. 2008;23(12):2079-86.
15. Darnaud C, Thomas F, Pannier B, Danchin N, Bouchard P. Oral Health and Blood Pressure: The IPC Cohort. Am J Hypertens. 2015;28(10):1257-61.
16. Loe H. Periodontal disease. The sixth complication of diabetes mellitus. Diabetes Care. 1993;16(1):329-34.
17. Preshaw PM, Alba AL, Herrera D, Jepsen S, Konstantinidis A, Makrilakis K, et al. Periodontitis and diabetes: a two-way relationship. Diabetologia. 2012;55(1):21-31.
18. Van Dyke TE, van Winkelhoff AJ. Infection and inflammatory mechanisms. J Clin Periodontol. 2013;40 Suppl 14:S1-7.
19. Paraskevas KI, Mikhailidis DP. C-reactive protein (CRP): more than just an innocent bystander? Curr Med Res Opin. 2008;24(1):75-8.
20. Reyes L, Herrera D, Kozarov E, Roldan S, Progulske-Fox A. Periodontal bacterial invasion and infection: contribution to atherosclerotic pathology. J Clin Periodontol. 2013;40 Suppl 14:S30-50.
21. Range H, Labreuche J, Louedec L, Rondeau P, Planesse C, Sebbag U, et al. Periodontal bacteria in human carotid atherothrombosis as a potential trigger for neutrophil activation. Atherosclerosis. 2014;236(2):448-55.
22. Axelsson P, Nystrom B, Lindhe J. The long-term effect of a plaque control program on tooth mortality, caries and periodontal disease in adults. Results after 30 years of maintenance. J Clin Periodontol. 2004;31(9):749-57.
23. Engebretson S, Kocher T. Evidence that periodontal treatment improves diabetes outcomes: a systematic review and meta-analysis. J Clin Periodontol. 2013;40 Suppl 14:S153-63.
24. Teeuw WJ, Slot DE, Susanto H, Gerdes VE, Abbas F, D’Aiuto F, et al. Treatment of periodontitis improves the atherosclerotic profile: a systematic review and meta-analysis. J Clin Periodontol. 2014;41(1):70-9.
25. Needleman I, Suvan J, Moles DR, Pimlott J. A systematic review of professional mechanical plaque removal for prevention of periodontal diseases. J Clin Periodontol. 2005;32 Suppl 6:229-82.
26. van der Weijden GA, Hioe KP. A systematic review of the effectiveness of self-performed mechanical plaque removal in adults with gingivitis using a manual toothbrush. J Clin Periodontol. 2005;32 Suppl 6:214-28.
27. Fabbri S, Johnston DA, Rmaile A, Gottenbos B, De Jager M, Aspiras M, et al. High-Velocity Microsprays Enhance Antimicrobial Activity in Streptococcus mutans Biofilms. J Dent Res. 2016;95(13):1494-500.
28. Poklepovic T, Worthington HV, Johnson TM, Sambunjak D, Imai P, Clarkson JE, et al. Interdental brushing for the prevention and control of periodontal diseases and dental caries in adults. Cochrane Database Syst Rev. 2013(12):CD009857.
29. Mwatha A, Olson M, Souza S, Ward M, Jenkins W, Amini P, et al. Gingival Health and Plaque Regrowth Response Following a Four-Week Interdental Hygiene Intervention. J Clin Dent. 2017;28(1 Spec No A):A36-44.