Introduction
La micronutrition est une voie complémentaire au traitement parodontal. Elle accompagne la phytothérapie l’aromathérapie, l’homéopathie, l’allopathie et le traitement en bouche.
Il s’agit d’optimiser la thérapeutique parodontale locale incontournable.
Nous allons l’aborder dans le cadre de la stratégie thérapeutique parodontale incluant le triptyque synergique de la micronutrition.
• Diminuer l’inflammation : penser aux Oméga 3.
• Moduler l’immunité : penser à la Vitamine D.
• Équilibrer le métabolisme acide-base : penser au Magnésium.
Stratégie thérapeutique triptyque
Dans l’approche thérapeutique de la maladie parodontale, de nombreux tests scientifiques intègrent l’utilisation de la micronutrition comme une solution d’accompagnement pertinente.
Face à la maladie parodontale chronique, une triple action sur le terrain est à mener :
1- Diminuer l’inflammation.
2- Moduler l’immunité.
3- Équilibrer le métabolisme acide-base.
Pour rappel, nous allons poser les faits :
Cliniquement, la destruction des tissus de soutien de la dent a été mise en évidence.
En 1986, Listgarten a fait une description détaillée dans le Journal scientifique, J Clin Periodonto dans son article « Pathegenesis of periodontitis », 13(5) : 418-30.
Néanmoins, dès 1979, Socransky apportait la compréhension des facteurs déclenchants en apportant les 4 mécanismes réactionnels mis en jeu dans le processus de la maladie parodontale :
1- Bactéries virulentes présentes dont Prophyromonas Gingivalis.
2- Bactéries protectrices absentes.
3- Système immunitaire défaillant.
4- Contexte dento-gingival défavorable.
Et aussi, facteurs favorisant la maladie parodontale :
Les maladies parodontales sont favorisées entre autres, par des habitudes d’hygiène de vie d’autant plus nuisibles qu’elles correspondent à une action agressive régulière et répétée au quotidien.
Nous pouvons répertorier : le tabagisme, la malnutrition avec le déséquilibre acide-base engendré entre autres, par le stress, les baisses de défenses immunitaires et certains médicaments.
Nous allons aborder, les trois types d’action qui fonctionnent en synergie, dans le cadre de la micronutrition.
Diminuer l’inflammation : penser aux Oméga 3
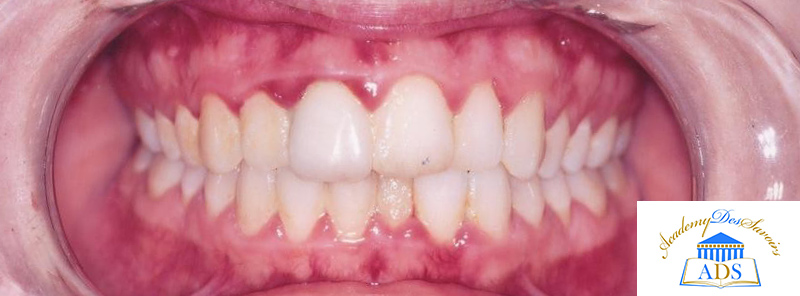
Fig. 01 : inflammation gingivale.
Stratégie thérapeutique : un accompagnement raisonné en micronutrition.
Le traitement parodontal reste incontournable et indispensable. La micronutrition est un apport additionnel dans nos thérapeutiques.
En micronutrition, les acides gras Oméga 3 sont polyinsaturés et dits Essentiels. Ils sont nécessaires pour l’organisme mais ne sont pas synthétisés par celui-ci. Dans l’alimentation, nous pouvons les trouver principalement dans certains poissons gras et dans certaines huiles dont celle de colza et de noix.
La quantité quotidienne recommandée se situe autour de 500 mg/jour selon l’étude de Gebauer en 2006.
Néanmoins, selon l’organisme EFSA, (European Food Savety Authority) soit l’Autorité européenne de sécurité des aliments, il n’y a pas d’apport maximal tolérable.
Il a été montré que les Oméga 3 ont des effets anti-inflammatoires donc une action protectrice sur le parodonte par l’EPA, acide éicosapentaénoïque et par le DHA, acide docosahexaénoïque. Ils vont se lier à un récepteur, le GRP120 et inhiber alors, l’expression de certains signaux inflammatoires.
Il a été montré par des études cliniques parodontales associées à un questionnaire nutritionnel très précis qu’il existait un lien entre Oméga 3 et parodontite. L’étude en 2010 de Naqvi et collaborateurs en 2010 sur 9182 personnes a mis en évidence que les apports en Oméga 3 surtout en EPA et en DHA sont inversement proportionnels à l’apparition des parodontites.
D’autres études complémentaires ont confirmé ce rôle protecteur des Oméga 3 par modulation de l’inflammation.
L’impact sur l’inflammation parodontale est marqué par la diminution significative des concentrations gingivales de PGE2 et PGF2 alpha dans des parodontites expérimentales dans l’étude pertinente de Vardar et collaborateurs en 2004.
Un point complémentaire sur le plan osseux par l’étude de Bendyk et collaborateurs en 2009 porte sur l’impact des Oméga 3. Chez l’animal, la perte osseuse alvéolaire est inversement liée aux concentrations tissulaires en Oméga 3. Des études cliniques sont en cours chez l’humain.
Elles s’orientent vers des perspectives satisfaisantes de conseiller une supplémentation en Oméga 3 pour optimiser la thérapeutique parodontale.
La supplémentation conseillée en Oméga 3 est de 1 gr/jour en moyenne.
Moduler l’immunité : penser à la Vitamine D
Pour rappel, en cas d’insuffisance du système immunitaire, celui-ci se retourne contre l’hôte infecté par une réponse inflammatoire intensifiée. Ce point peut concerner le parodonte.
Il va s’agir d’une surproduction de certaines molécules initialement protectrices, qui deviennent dès lors, destructrices. La concentration abondante en cytokines, IL-1 béta, en TNF alpha, notamment est identifiée.
En outre, au niveau gingival, une induction de la production de collagénases et de prostaglandines PGE2 par les fibroblastes gingivaux va conduire à la perte d’attache dans la pathogénésie de la maladie parodontale.
La Vitamine D a montré son intérêt multiple à différents niveaux de la santé de l’individu.
Dans la pathologie parodontale, son action s’est mise en évidence.
La Vitamine D est une vitamine liposoluble. Deux voies de synthèse coexistent :
• Un apport exogène par l’alimentation,
• Un apport endogène de synthèse par l’organisme humain, au niveau de la peau, via un dérivé du cholestérol (7-déhydrocholestérol) et sous l’action des rayonnements UVB de la lumière.
Les apports exogènes sont de types D2 ou D3 menant à Vitamine D différentes.
• Type D2 : ergocalciférol est d’origine végétale. Les aliments qui en contiennent sont entre autres les champignons, les levures et les céréales.
• Type D3 : cholécalciférol est d’origine animale. Les aliments qui en contiennent sont entre autres l’huile de foie de morue, les poissons gras ou demi-gras tels que truite ou rouget, et aussi lait beurre, fromages, œufs.
Il a été démontré que la Vitamine sous forme D3 élève plus efficacement le taux sanguin circulant de la 1,25 dihydroxyvitamine D que la Vitamine D2.
À doses physiologiques, la vitamine D permet la fixation du calcium sur l’os.
Il a été montré dans des études épidémiologiques conséquentes de plus de 10 000 personnes que la carence en Vitamine D est associée à une perte d’attache parodontale. Elle a une action immuno-modulatrice sur la pathologie parodontale.
Un apport optimal en vitamine D et calcium diminue la résorption osseuse et assure une bonne minéralisation osseuse selon l’étude de Dixon et collaborateurs en 2009. L’étude de Miley et collaborateurs en 2009 sur 50 sujets fait le même constat : l’apport Vitamine D et calcium correspond à une voie supplémentaire dans la gestion de la pathologie parodontale.
Néanmoins, il est à savoir qu’en pratique la vitamine D peut être prescrite seule ou en association avec le calcium.
L’Apport Journalier recommandé, l’AJR a été revu à la hausse par l’Europe, en 2016.
Les recommandations en vitamine D sont passées à 15 µg / jour dans l’Union européenne soit 600 UI / jour.
Équilibrer le métabolisme acide-base : penser au Magnésium
Pour rappel, le déséquilibre acido-basique participe à des effets délétères sur le long terme sur tout l’organisme dont la sphère bucco-dentaire. Il participe notamment à des inflammations tissulaires, des faiblesses immunitaires, avec une incidence négative sur la santé parodontale.
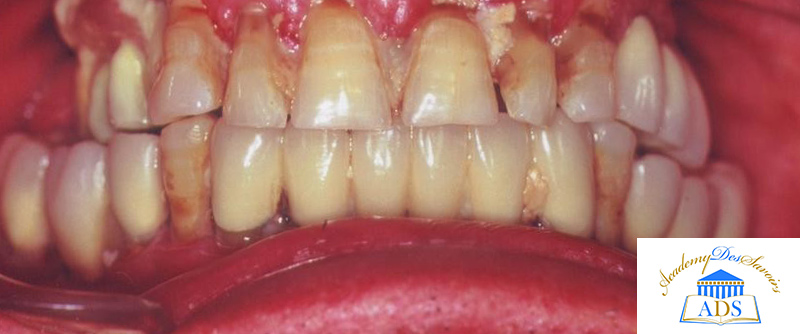
Fig. 02 : atteinte parodontale généralisée.
Stratégie thérapeutique : un accompagnement raisonné en micronutrition.
L’équilibre acide-base est un point important pour optimiser le bon fonctionnement des organes et du système immunitaire. Pour prévenir ou aboutir à cet équilibre, l’alimentation a un rôle primordial. Pourtant, l’alimentation « moderne » nous amène vers une « suracidose métabolique latente », vers un terrain acide.
Ce constat a des effets délétères sur le long terme.
La porte est alors ouverte vers des maladies chroniques, de la fatigue, des faiblesses immunitaires des inflammations tissulaires avec une incidence sur la santé parodontale aussi.
Il est en conséquence nécessaire de savoir prévenir par le choix des aliments bénéfiques. Deux catégories d’aliments sont à repérer : les aliments acidifiants et les aliments alcalins sont identifiés grâce à des tableaux préexistants établis en précisant les degrés. Ce repère est fort utile en aide mémo-technique.
Ainsi, des aliments habituellement alcalinisants comme les fruits, peuvent être pour certains d’entre eux, acidifiants. Les deux exemples caractéristiques sont l’abricot et la prune qui sont des aliments acidifiants.
Par ailleurs, des aliments alcalinisants peuvent faire croire qu’ils sont acidifiants du fait du goût acide. L’exemple typique est le citron (l’acide citrique) qui a un goût acide en bouche mais qui donne après ingestion, un résidu alcalin. Ses acides sont en fait volatils et exhalés par les poumons.
En résumé, les aliments à pouvoir alcalinisant restent les fruits et les légumes grâce au profil cationique, potassium, magnésium, calcium, et grâce au profil anionique, citrate et malate. Une alimentation dite « alimentation santé » doit contenir environ 30 % d’aliments acidifiants et 70 % d’aliments alcalinisants. La résultante est une alimentation qui ne supprime pas les acides mais qui sait privilégier les fruits et légumes tout en réduisant les protéines animales, graisses saturées et fromages affinés.
En outre, sur le plan de la maladie parodontale, dans cet équilibre acide-base, un oligo-élément minéral a montré un rôle majeur : le Magnésium. Meisel et collaborateurs ont montré en 2005 au travers d’une étude clinique sur plus de 4 000 personnes âgées de 20 à 80 ans, l’impact du manque de Magnésium sur la maladie parodontale.
Ils ont montré qu’une augmentation du rapport sérique en calcium-magnésium diminuait à la fois, la profondeur du sondage de la poche parodontale et la perte d’attache, chez les patients de plus de 40 ans. Puis, en 2006, dans cette continuité, Merchant a montré que le Magnésium permet d’une part une meilleure santé parodontale et d’autre part, diminuerait le risque de maladie parodontale.
L’apport recommandé en magnésium est de 375 mg/ jour. Il est à considérer que l’apport doit être augmenté pour les sportifs, les femmes enceintes, les patients stressés, les terrains dépressifs, entre autres.
Pour conclure
En clair, il est à comprendre que notre objectif de praticien est d’utiliser l’ensemble de l’arsenal thérapeutique et d’accompagnement, afin d’optimiser la réponse au traitement. L’accompagnement thérapeutique par la micronutrition est une façon concrète de mettre en œuvre une approche complète du patient.
Ce point est d’autant plus essentiel dans la maladie parodontale que nous savons que nous sommes en présence d’une maladie plurifactorielle et que la nutrition adaptée a montré des voies complémentaires de portée positive, au regard des nombreuses études exposées. Les études de recherche se poursuivent.
En conséquence, l’approche globale du patient avec tous les paramètres va en faveur d’aider au mieux notre patient grâce à cette approche de la « nutrition-santé » dans le cadre des maladies du parodonte, gencives et os dentaire.
En résumé, la Nutrition-Santé dans la maladie parodontale peut s’accompagner du Trio synergique suivant : Oméga-3, Vitamine D et Magnésium.
La micronutrition est donc une approche complémentaire pertinente pour optimiser nos thérapeutiques pour la santé parodontale du patient.
Références bibliographiques
Boukhobza F. Maladies parodontales : Approches complémentaires et micronutrition ;
Conférence, Novembre 2014, Academy Des Savoirs, Paris.
Boukhobza F. Fiche thérapeutique : Agir face à la maladie parodontale : 3 volets ;
Lereca : Avril 2015.
Boukhobza F. et Goetz P. La Phytothérapie en odontologie ;
Éditions CDP, Collection Guide clinique, publié le Janvier 2018, 217 p. 2è édition.
Bendyk et Al. Effect of dietary omega-3 polyunsaturated fatty acids on experimental periodontitis in the mouse ;
J Periodontal Res, 2009 Apr; 44(2): 211-6.
Dixon et Al. Calcium and vitamin D use among adults in periodontal disease maintenance programmes ;
Br Dent J., 2009 Jun; 206(12) : 627-31.
Garcia et Coll. One-year effects of vitamin D and calcium supplementation on chronic periodontitis ;
J Periodontol. 2011 Jan; 82(1):25-32.
Gebauer Fatty acid dietary recommendations and food sources to achieve essentiality and cardiovascular benefits ;
Am J Clin Nutr., 83(6Suppl): 1526S-1535S.
Listgarten Pathegenesis of periodontitis ;
J Clin Periodonto, 1986 13(5): 418-30.
Meisel et Coll. Magnesium deficiency is associated with periodontal disease ;
J dent Res., 2005 Oct; 84(10) : 937-41.
Merchant Higher serum magnesium:calcium ratio may lower periodontitis risk ;
J Evid Based Dent Pract., 2006 Dec; 6(4):285-6.
Miley et Coll. Cross-sectional study of vtamin D and calcium supplementation on chronic periodontitis ;
J Periodontol. 2009 Sep; 80(9):1433-9.
Naqvi et Al. Fatty acids and periodontitis in US adults ;
J Am Diet Assoc., 2010, 110(11): 1669-75.
Socransky Criteria for the infectious agents in dental caries and periodontal disease ;
J Clin Periodontal., 1979; 6(7): 16-21.
Vardar et Al. Therapeutic versus prophylactic plus administration of omega-3 fatty acid on endotoxin-induced periodontitis in rats ;
J Periodontol. 2004 Dec; 75(12): 1640-6.